Кроссинговер

Кроссинго́вер (от англ. crossing over — пересечение) — процесс обмена участками гомологичных хромосом во время конъюгации в профазе первого деления мейоза, которое происходит, например, при образовании гамет или спор. Помимо мейотического, описан также митотический кроссинговер.
Чем ближе друг к другу находятся гены, тем реже между ними происходит кроссинговер, поэтому на основе частот кроссинговера можно судить о взаимном расположении генов и расстоянии между ними, то есть картировать гены. Кроссинговер был описан в 1911 году американским генетиком Томасом Хантом Морганом и его студентом и сотрудником Альфредом Стёртевантом у плодовой мушки Drosophila melanogaster. В 1913 году Стёртевант начал составление генетических карт на основании частот кроссинговера. В 1933 году Морган стал лауреатом Нобелевской премии по физиологии и медицине «За открытия, связанные с ролью хромосом в наследственности»[1].
История открытия[править | править код]

Первыми кроссинговер обнаружили Томас Х. Морган и его студент Альфред Х. Стёртевант у плодовой мушки Drosophila melanogaster в 1911 году при анализе многочисленных мутаций, локализованных в X-хромосоме. Морган анализировал результаты двух скрещиваний: в одном самок с жёлтым телом и белыми глазами скрещивали с самцами дикого типа (серое тело, красные глаза), а в другом скрещивали самок с белыми глазами и маленькими крыльями и самцами дикого типа. В первом скрещивании в первом поколении (F1) все самки были дикого типа, а у самцов проявились оба мутантных признака; во втором поколении (F2) подавляющее большинство мух имело фенотипы родителей (дикого типа или жёлтое тело и белые глаза), но у менее чем 1 % мух имелось либо жёлтое тело с красными глазами, либо серое тело с белыми глазами. Во втором скрещивании в F2 также появлялись мухи с рекомбинантными фенотипами, причём их доля составила 34,5 %[2].
К моменту проведения вышеописанных экспериментов уже были описаны хиазмы при синапсисе гомологичных хромосом в мейозе у земноводных (их описал Ф. А. Янссенс в 1909 году). Морган предположил, что именно хиазмы были теми точками, в которых хромосомы обменивались своими участками, и для описания этого процесса ввёл термин «кроссинговер». Разность в доле рекомбинантных фенотипов, полученных в первом и втором экспериментах, он объяснил различным расстоянием между генами: частота формирования хиазм между близко расположенными генами меньше, чем между более удалёнными[2].
Цитологические основы[править | править код]

В 1909 году Ф. А. Янссенс описал образование хиазм — характерных структур, которые формируют гомологичные хромосомы при кроссинговере — при мейозе у земноводных. Янссенс также высказал предположение, что хиазмы могут свидетельствовать об обмене хромосом генетическим материалом. Доказательства того, что образование хиазм сопровождается обменом участками гомологичных хромосом, были получены в 1931 году для кукурузы и для дрозофилы[3].
Исследованиями на кукурузе занимались Харриет Крейтон и Барбара Мак-Клинток. Они изучали особую форму кукурузы, дигетерозиготную по двум генам: c и wx, которые определяют окраску эндосперма. Гены c и wx локализованы на одной хромосоме, причём у исследуемой формы кукурузы одна из двух гомологичных хромосом, содержащих эти гены, на одном конце несла протяжённый участок гетерохроматина, а на другом — транслоцированный участок другой хромосомы. Вторая гомологичная хромосома указанных цитогенетических особенностей не имела. Исследования рекомбинантного потомства, полученного при скрещивании описанной формы кукурузы с растениями, рецессивными по генам c и wx, показали, что у рекомбинантных растений происходило перемещение гетерохроматинового блока или транслоцированного участка на вторую гомологичную хромосому, то есть хромосомы действительно физически обменивались своими участками[4].
Исследования на дрозофиле по той же схеме проводил Курт Штерн. Он получил линию самок дрозофилы, дигетерозиготных по генам cr и B, которые локализованы на X-хромосоме и определяют окраску и форму глаз соответственно. У этих самок X-хромосомы были гетероморфные: одна из них была Г-образная, так как содержала небольшой фрагмент Y-хромосомы, а другая была сильно укорочена из-за транслокации её участка (не содержащего центромеру) на четвёртую хромосому. Описанных самок скрестили с самцами, рецессивными по генам cr и B и имеющими нормальные X- и Y-хромосомы. Рекомбинантное потомство (только самок, так как Y-хромосому самцов можно было спутать с Г-образной X-хромосомой) исследовали цитологически и установили, что их X-хромосомы претерпели структурные изменения, что свидетельствует о факте переноса фрагментов между X-хромосомами, то есть кроссинговере[5].
Когда физическая природа кроссинговера была окончательно установлена, возник вопрос, на какой стадии клеточного цикла он происходит. Теоретически кроссинговер может происходить до репликации хромосом (на стадии двух нитей), так и после неё (на стадии четырёх нитей). Для ответа на этот вопрос был использован тетрадный анализ с использованием сумчатого гриба — хлебной плесени Neurospora crassa. Образование гаплоидных спор у этого организма происходит внутри особых структур — сумок (асков) и включает два деления: мейоз и последующий митоз, поэтому зрелый аск содержит восемь гаплоидных спор. Ось веретена деления при мейозе совпадает с продольной осью аска, поэтому в аске в один ряд располагаются четыре пары гаплоидных спор, и генотип каждой пары спор идентичен. При исследовании порядка расположения и генотипа спор в аске было показано, что кроссинговер происходит после удвоения хромосом, то есть когда каждая из них состоит из четырёх хроматид. Если бы кроссинговер происходил до репликации хромосом, то в аске гриба, дигетерозиготного по генам A и B (то есть имеющего генотип AaBb) содержалось бы 4 споры с генотипом Ab и 4 споры с генотипом aB. В действительности в асках грибов с указанным генотипом выявляются споры четырёх генотипов, порядок расположения которых в аске зависит от того, между какими несестринскими хроматидами произошёл кроссинговер. Тот факт, что кроссинговер происходит на стадии четырёх хроматид, удалось продемонстрировать и на дрозофиле. Это сделали в 1925 году Кэлвин Бриджес и И. Андерсон[6].
В настоящее время известно, что кроссинговер происходит в профазе первого деления мейоза, которую подразделяют на несколько стадий. Первая стадия, лептотена, знаменуется конденсацией удвоенных хромосом, благодаря которой они становятся видимыми. Спаривание участков гомологичных хромосом начинается в следующей стадии, зиготене, а на следующей стадии, пахитене, гомологичные хромосомы становятся спаренными по всей своей длине. Такие структуры, состоящие из двух соединённых гомологичных хромосом, называют бивалентами, а сам процесс спаривания гомологов также называют синапсисом. Гомологичные хромосомы удерживаются вместе сложным белковым комплексом, который называется синаптонемным комплексом. На следующей стадии, в диплотене, хромосомы разделяются, но продолжают удерживаться в местах хиазм, где происходит кроссинговер. Последняя стадия профазы первого деления мейоза, диакинез, сопровождается ещё большей конденсацией хромосом, при которой становятся различимыми все четыре хроматиды, но хиазмы остаются[7].
Молекулярный механизм[править | править код]
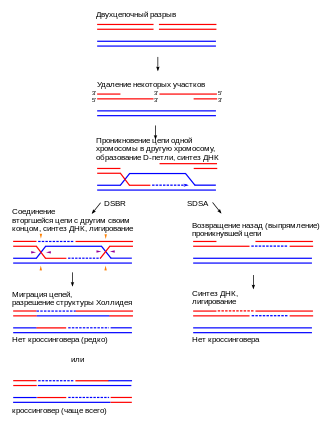
Чаще всего кроссинговер начинается, когда белок Spo11 делает целевые двойные разрезы в цепи ДНК[8] строго определённым образом, преимущественно в промоторах и GC-обогащённых областях[9]. Обычно эти области находятся в так называемых горячих точках рекомбинации — участках, состоящих из приблизительно 1000—2000 пар оснований и имеющих высокую частоту рекомбинации. Отсутствие горячих точек рядом с двумя генами в одной и той же хромосоме часто означает, что эти гены будут унаследованы будущими поколениями в равной пропорции[10]. В основе кроссинговера лежит гомологичная рекомбинация, которая также играет важную роль в репарации двуцепочечных разрывов[11].
Известно два основных механизма гомологичной рекомбинации: путь репарации двуцепочечных разрывов (DSBR-путь), также известный как модель двойной структуры Холлидея, и путь синтезозависимого отжига цепи (SDSA-путь)[12]. Кроссинговер происходит в ходе DSBR-пути. Оба начинаются одинаковым образом. Когда двуцепочечный разрыв в цепи обнаружен, белковый комплекс MRX (у человека MRN) встает по обе стороны от разрыва, после чего следует отрезание 5'-концов, проходящее в два отдельных этапа. Первый этап заключается в том, что MRX в паре с белком Sae2 вырезают 5'-концы цепи около разрыва, тем самым оставляя выступающие 3'-концы. Второй этап 5' → 3'-отрезания продолжает геликаза Sgs1 и нуклеазы Exo1 и Dna2. Sgs1 «расстёгивает» двойную спираль, а Exo1 и Dna2 создают разрывы в одноцепочечной ДНК, высвобожденной Sgs1[13].
Репликативный белок А (RPA), имеющий высокое сродство к одноцепочечной ДНК, связывает выступающие 3'-концы[14] и с помощью ряда других белков, которые опосредуют процесс, например Rad51 (и Dmc1 в мейозе), формирует комплекс с одноцепочечной ДНК, покрывая её. Затем нуклеопротеидная нить ищет похожую или идентичную цепь ДНК и внедряется в неё, когда находит. В клетках, делящихся путём митоза, «жертвой» внедрения (реципиентным ДНК-дуплексом) обычно является сестринская хроматида, идентичная повреждённой ДНК, которая чаще всего используется в качестве матрицы для репарации. В мейозе, однако, реципиентным ДНК-дуплексом служит гомологичная хромосома, которая очень похожа на повреждённую хромосому, но не обязательно идентична ей[12].
В ходе вторжения цепи между торчащим 3'-концом внедряющейся цепи и гомологичной хромосомой образуется D-петля. После этого ДНК-полимераза продлевает 3'-концы. Получившаяся перекрёстная структура называется структурой Холлидея. Вслед за этим на внедрённой цепи (то есть на одном из выступающих 3'-концов) происходит синтез ДНК, эффективно восстанавливая её комплементарно гомологичной хромосоме в том месте, откуда была вытеснена D-петля[12].
DSBR-путь уникален тем, что на втором выступающем 3'-конце (который не участвовал во внедрении) также образуется структура Холлидея с цепью гомологичной хромосомы. Далее двойная структура Холлидея становится продуктом рекомбинации под действием никирующих эндонуклеаз — рестриктаз, вносящих разрыв только в одну цепь ДНК[15][16]. Приведёт DSBR к кроссинговеру или нет, определяется тем, как будет разрезана, или «разрешена», структура Холлидея. Кроссинговер может произойти, если одна структура Холлидея будет разрезана по пересекающимся нитям, а другая нет. Продукт, не подвергшийся кроссинговеру, получится лишь в том случае, если обе структуры разрешены по пересекающимся нитям[17].
Митотический кроссинговер[править | править код]

Хотя в подавляющем большинстве случаев кроссинговер приурочен к мейозу, описан и митотический кроссинговер, который может проходить в соматических клетках при митотических делениях как у организмов, обладающих полом, так и бесполых организмов (например, некоторых одноклеточных грибов, у которых не известен половой процесс). В случае бесполых организмов митотическая рекомбинация является единственным ключом к пониманию сцепления генов, так как у таких организмов это единственный способ генетической рекомбинации[18]. Кроме того, митотическая рекомбинация может привести к мозаичной экспрессии рецессивных аллелей у гетерозиготной особи. Такая экспрессия имеет важное значение в онкогенезе, она также позволяет изучать летальные рецессивные мутации[18][19].
Кроссинговер и картирование генов[править | править код]
Ученик Моргана Альфред Стёртевант первым предположил использовать сведения о частоте кроссинговера между определёнными локусами для определения расстояния между ними на хромосоме и взаимного порядка расположения, то есть для картирования генов. В 1913 году он скрещивал мух, гомозиготных по локализованным на X-хромосоме мутациям yellow (жёлтое тело), white (белые глаза) и miniature (маленькие, недоразвитые крылья). Частота рекомбинации между локусами white и miniature, а также yellow и miniature была примерно одинаковой (34,5 % и 35,4 % соответственно), а вот между генами yellow и white рекомбинация происходила с частотой всего лишь 0,5 %. Стёртевант предположил, что, чем физически ближе локусы расположены на хромосоме, тем реже они рекомбинируют, поэтому эти гены, вероятнее всего, на хромосоме находятся в порядке yellow — white — miniature. На основании частот рекомбинаций Стёртевант построил генетическую карту X-хромосомы дрозофилы, причём одна условная единица карты соответствует 1 % рекомбинации. Единицу генетической карты в честь Моргана назвали сантиморганом (сМ). Дальнейшие исследования показали, что кроссинговер характерен не только для X-хромосомы, но и для аутосом. Любопытно, что у дрозофилы, в отличие от большинства других животных, кроссинговер не происходит у самцов[20].
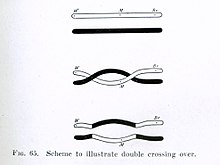
Между несестринскими хроматидами нередко происходит более одного кроссинговера, например, широко распространён так называемый двойной кроссинговер. Существование множественного кроссинговера нарушает точную аддитивность частоты рекомбинации между генами: из трёх линейно расположенных генов частота рекомбинации между крайними генами в действительности несколько ниже суммы частот рекомбинаций между первым и вторым геном и между вторым и третьим[21]. С увеличением расстояния между двумя генами хромосомная карта становится менее точной, потому что бесчисленные случаи кроссинговера между локусами, разделяющими эти гены, остаются неучтёнными. Из-за множественного кроссинговера частота рекомбинаций недооценивается, а определённое экспериментально межгенное расстояние меньше реального[22].
Однако кроссинговер между двумя генами в ряде случаев затрудняет обмен между соседними участками. Это явление получило название интерференции, а для оценки её выраженности используют так называемый коэффициент коинцидентности C, который равен отношению количества наблюдаемых двойных кроссинговеров к числу теоретически ожидаемых; величину интерференции характеризуют величиной I, равной 1 — C. В случае отрицательной интерференции, когда I > 0, частота двойных кроссинговеров больше ожидаемой; такое явление описано, в частности, у кукурузы. Однако гораздо шире распространена положительная интерференция, при которой I < 0 и кроссинговер между двумя локусами подавляет кроссинговер между соседними участками. Как правило, чем ближе расположены гены, тем больше положительная интерференция[23].
На основании анализа частот рекомбинаций удалось составить генетические карты некоторых организмов, однако в ряде случаев, например, в случае человека, такая процедура сильно затруднена. С развитием методов секвенирования ДНК стало возможно картирование генов человека, причём для этого используются так называемые ДНК-маркеры — короткие фрагменты ДНК с известной последовательностью и локализацией на хромосомах, которые являются удобными ориентирами для построения хромосомных карт. Одними из первых ДНК-маркеров были полиморфизмы длин рестрикционных фрагментов и микросателлиты, позднее в роли маркеров стали использовать однонуклеотидные полиморфизмы[24].
Факторы, влияющие на кроссинговер[править | править код]
На частоту мейотического и митотического кроссинговера оказывают влияние некоторые факторы окружающей среды. Различные виды излучения (УФ-, рентгеновское и γ-излучение) в большинстве случаев увеличивают частоту кроссинговера, так как вызывают одно- и двуцепочечные разрывы в ДНК. Излучение может влиять на рекомбинацию лишь в некоторых участках хромосом; так, у дрозофилы под действием излучения в прицентромерных районах частота кроссинговера повышается, а в удалённых от центромер — понижается. Частоту кроссинговера увеличивают многие вещества, нарушающие структуру ДНК и препятствующие нормальной репликации, такие как нитрозосоединения, а также агенты, алкилирующие и дезаминирующие азотистые основания. На частоту рекомбинации также может оказывать влияние температура[25].
Частота кроссинговера связана с физиологическим состоянием организма. Чем старше самки дрозофил, тем реже у них происходит кроссинговер. Голодание личинок повышает частоту кроссинговера, а недостаток воды, наоборот, понижает. Существует и генетический контроль частоты кроссинговера. Например, как отмечалось выше, кроссинговер отсутствует у самцов дрозофил, а также у самок тутового шелкопряда. Вообще, как правило, у гетерогаметного пола кроссинговер происходит реже. На частоту кроссинговера влияют некоторые хромосомные перестройки и определённые мутации[26].
Примечания[править | править код]
- ↑ The Nobel Prize in Physiology or Medicine 1933 (англ.). Nobel Media AB 2013. Дата обращения: 11 декабря 2013. Архивировано 21 августа 2007 года.
- ↑ 1 2 Клаг и др., 2016, с. 227.
- ↑ Инге-Вечтомов, 2010, с. 182.
- ↑ Инге-Вечтомов, 2010, с. 183.
- ↑ Инге-Вечтомов, 2010, с. 183—184.
- ↑ Инге-Вечтомов, 2010, с. 186—188.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 351—352.
- ↑ Keeney S., Giroux C. N., Kleckner N. Meiosis-specific DNA double-strand breaks are catalyzed by Spo11, a member of a widely conserved protein family. (англ.) // Cell. — 1997. — Vol. 88, no. 3. — P. 375—384. — PMID 9039264.
- ↑ Longhese M. P., Bonetti D., Guerini I., Manfrini N., Clerici M. DNA double-strand breaks in meiosis: checking their formation, processing and repair. (англ.) // DNA repair. — 2009. — Vol. 8, no. 9. — P. 1127—1138. — doi:10.1016/j.dnarep.2009.04.005. — PMID 19464965.
- ↑ Cahill L. P., Mariana J. C., Mauléon P. Total follicular populations in ewes of high and low ovulation rates. (англ.) // Journal of reproduction and fertility. — 1979. — Vol. 55, no. 1. — P. 27—36. — PMID 423159.
- ↑ Кребс, Голдштейн, Килпатрик, 2017, с. 352—353.
- ↑ 1 2 3 Sung P., Klein H. Mechanism of homologous recombination: mediators and helicases take on regulatory functions. (англ.) // Nature reviews. Molecular cell biology. — 2006. — Vol. 7, no. 10. — P. 739—750. — doi:10. 1038/nrm2008. — PMID 16926856.
- ↑ Mimitou E. P., Symington L. S. Nucleases and helicases take center stage in homologous recombination. (англ.) // Trends in biochemical sciences. — 2009. — Vol. 34, no. 5. — P. 264—272. — doi:10.1016/j.tibs.2009.01.010. — PMID 19375328.
- ↑ Wold M. S. Replication protein A: a heterotrimeric, single-stranded DNA-binding protein required for eukaryotic DNA metabolism. (англ.) // Annual review of biochemistry. — 1997. — Vol. 66. — P. 61—92. — doi:10.1146/annurev.biochem.66.1.61. — PMID 9242902.
- ↑ Nelson D. L., Cox MM. Principles of Biochemistry (неопр.). — 4th. — Freeman, 2005. — С. 980—981. — ISBN 978-0-7167-4339-2.
- ↑ Marcon E., Moens P. B. The evolution of meiosis: recruitment and modification of somatic DNA-repair proteins. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2005. — Vol. 27, no. 8. — P. 795—808. — doi:10.1002/bies.20264. — PMID 16015600.
- ↑ Альбертс и др., 2013, с. 466—484.
- ↑ 1 2 Hartel, Daniel L. and Maryellen Ruvolo. Genetics: Analysis of Genetics and Genomes (англ.). — Burlington: Jones & Bartlett, 2012.
- ↑ Tischfield J. A. Loss of heterozygosity or: how I learned to stop worrying and love mitotic recombination. (англ.) // American Journal Of Human Genetics. — 1997. — November (vol. 61, no. 5). — P. 995—999. — doi:10.1086/301617. — PMID 9345110.
- ↑ Клаг и др., 2016, с. 228—229.
- ↑ Клаг и др., 2016, с. 231—232.
- ↑ Клаг и др., 2016, с. 240.
- ↑ Клаг и др., 2016, с. 240—242.
- ↑ Клаг и др., 2016, с. 242.
- ↑ Инге-Вечтомов, 2010, с. 204.
- ↑ Инге-Вечтомов, 2010, с. 205—206.
Литература[править | править код]
- Инге-Вечтомов С. Г. Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 978-5-94869-105-3.
- Клаг Уильям С., Каммингс Майкл Р., Спенсер Шарлотта А., Палладино Майкл А. Основы генетики. — М.: ТЕХНОСФЕРА, 2016. — 944 с. — ISBN 978-5-94836-416-2.
- Кребс Дж., Голдштейн Э., Килпатрик С. Гены по Льюину. — М.: Лаборатория знаний, 2017. — 919 с. — ISBN 978-5-906828-24-8.
- Б. Альбертс, А. Джонсон, Д. Льюис и др. Молекулярная биология клетки: в 3-х томах. — М. — Ижевск: НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — Т. 1. — 808 с. — ISBN 978-5-4344-0112-8.
Эта статья входит в число хороших статей русскоязычного раздела Википедии. |